Vaccine COVID-19: sự khác nhau giữa phê duyệt đầy đủ và phê duyệt khẩn cấp?
Hiện tại có nhiều loại vaccin được Bộ Y tế phê duyệt đưa vào sử dụng ở Việt Nam. Gần đây cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã cấp phép đầy đủ cho vaccine COVID-19 của hãng Pfizer-BioNTech. Điều này đặt ra một câu hỏi: sự khác biệt giữa phê duyệt đầy đủ và giấy phép phê duyệt sử dụng khẩn cấp cho một vaccine trước đó là gì? Những quy định này có gì khác nhau?
Phê duyệt giấy phép sử dụng khẩn cấp là gì?
Ban đầu, các vaccine COVID-19 được triển khai theo giấy phép EUA (Emergency Use Authorization – giấy phép sử dụng khẩn cấp) của FDA ban hành, với mục đích cho phép loại vaccine sử dụng trong những trường hợp khẩn cấp về sức khỏe cộng đồng. Theo quy trình cấp phép này, các cơ quan có thẩm quyền đã loại bỏ đi một số yêu cầu thường xuyên đối với dữ liệu của vaccine, đồng thời cũng làm giảm các quy trình đánh giá để vaccine có thể được tiêm sớm hơn vài tháng so với khả năng dự kiến được phép trong các tình huống bình thường (như việc phát triển một vaccine thông thường).
Theo báo cáo mới nhất, việc tiêm vaccine Pfizer cho các đối tượng từ 16 tuổi trở lên đã trải qua quá trình thử nghiệm và đánh giá với quy định nghiêm ngặt giống như các loại vaccine sử dụng trong tiêm chủng lâu đời khác. Với tính cấp bách, vaccine này ban đầu được cấp giấy phép khẩn cấp và đến thời điểm hiện tại, nó đã được FDA đã phê duyệt đầy đủ. Đương nhiên, việc phê duyệt đầy đủ khác với phê duyệt khẩn cấp, với các tiêu chuẩn chặt chẽ hơn.
Phê duyệt khẩn cấp có điểm gì khác so với phê duyệt đầy đủ?
Trước khi được sử dụng, bất kỳ loại vaccine nào cũng cần được FDA xem xét kỹ lưỡng. Cụ thể, FDA sẽ đánh giá hiệu quả, độ an toàn, hiệu lực và độ tinh khiết của mọi loại vaccine sau khi nó đã được chứng minh thông qua các thử nghiệm khắt khe, và thường bắt đầu bằng thử nghiệm trên động vật. Khi động vật trải qua tác động dự kiến mà vaccine mang lại (trừ các tác dụng phụ đáng kể), các thử nghiệm sẽ được thực hiện trên người, và được thực hiện trong ba giai đoạn.
Một loại vaccine nếu hứa hẹn sau khi trải qua các giai đoạn đầu sẽ được chuyển sang Giai đoạn 3 - khi hàng nghìn người tham gia sẽ được thử nghiệm và đánh giá. Trong giai đoạn này, một lần nữa các nhà nghiên cứu sẽ tiếp tục cố gắng tìm hiểu hiệu quả thực sự và tính an toàn của vaccine và sau đó, xác định xem có tác dụng phụ xảy ra hay không. Sau khi được phê duyệt, việc giám sát an toàn sẽ được thực hiện thông qua việc sử dụng các công cụ giám sát như hệ thống tiêm chủng…
Việc phê duyệt đầy đủ yêu cầu dữ liệu theo dõi lâu hơn - trong sáu tháng
Vaccine của Pfizer cùng với các vaccine khác của Moderna và Johnson & Johnson hiện vẫn được thử nghiệm trên hàng chục nghìn người để xác định tính an toàn và hiệu quả. Ban đầu, FDA yêu cầu các nhà sản xuất chỉ gửi dữ liệu giám sát an toàn trong khoảng 2 tháng đối với những người tình nguyện tham gia nghiên cứu, vì đây là khoảng thời gian mà các tác dụng phụ có nhiều khả năng xảy ra nhất. Khi hoàn thành các đánh giá trong thời gian này, vaccine sẽ được cấp giấy phê duyệt khẩn cấp.
Đối với việc phê duyệt đầy đủ, FDA yêu cầu các công ty sản xuất phải gửi dữ liệu theo dõi trong 6 tháng. Các thanh tra của cơ quan có thẩm quyền cũng đã đến kiểm tra các nhà máy sản xuất vaccine và đánh giá từng bước của quy trình sản xuất để đảm bảo rằng các mũi tiêm được thực hiện trong điều kiện an toàn và vô trùng. Vì vaccine thường được tiêm cho những người khỏe mạnh, chúng thường phải chịu sự giám sát chặt chẽ hơn so với các sản phẩm y tế khác.
Vaccine của Pfizer, Moderna và Johnson & Johnson
Hiện tại với sự chấp thuận hoàn toàn của FDA, vaccine của Pfizer đang mang lại sự chứng thực mạnh mẽ nhất về độ an toàn và tính hiệu quả. Các chuyên gia y tế đang hy vọng sự thay đổi này sẽ thuyết phục được nhiều người chưa tiêm đi tiêm nhiều hơn, cũng như thúc đẩy nhiều doanh nghiệp yêu cầu nhân viên đi tiêm vaccine hơn.
Hãng dược Moderna cũng đã trong quá trình đánh giá để được sự chấp thuận đầy đủ của FDA, trong khi đối với vaccine của Johnson & Johnson, hãng này đã thông báo rằng họ cũng hy vọng sẽ xin xét duyệt vào cuối năm nay.
Vaccine COVID-19 của Pfizer hiện được sử dụng cho các đối tượng từ 12 đến 15 tuổi theo giấy phép phê duyệt khẩn cấp. Bên cạnh đó, FDA vẫn đang cân nhắc và chưa đưa ra quyết định một cách độc lập xem có cần thiết phải sử dụng loại vaccine này cho mũi tiêm thứ 3 (mũi tiêm tăng cường) tại nhóm những người khỏe mạnh hay không.
Tham khảo thêm thông tin tại: Đánh giá hiệu quả và các tác dụng phụ không mong muốn của vaccine Vero Cell (Sinopharm)
-
Nhiễm nấm Candida: Triệu chứng và điều trị
Nấm Candida là một loại nấm men có thể sống trên cơ thể con người. Nó thường bao gồm cả nấm men và nấm mốc.
-

Gợi ý chế độ nghỉ ngơi để đảm bảo sức khỏe cho thí sinh trước mùa thi
Không chỉ chế độ dinh dưỡng đảm bảo mà việc nghỉ ngơi của các thí sinh cũng rất quan trọng để đảm bảo tinh thần được tốt nhất khi bước vào kỳ thi.
-
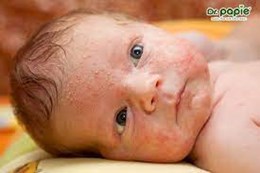
Chế độ ăn giúp trẻ bị rôm sảy mau khỏi
Trẻ bị rôm sảy cần được chăm sóc, điều trị đúng cách. Bên cạnh các biện pháp vệ sinh da thì chế độ dinh dưỡng hợp lý, đủ chất, bổ sung vitamin và khoáng chất sẽ tăng sức đề kháng cho trẻ, phòng ngừa biến chứng và giúp bệnh nhanh khỏi.
-
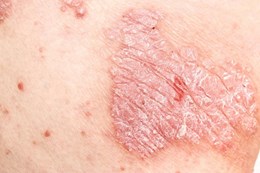
Cách đối phó với làn da bong tróc do vẩy nến
Bệnh vẩy nến là một bệnh về da gây phát ban ngứa, có vảy. Một trong những triệu chứng phổ biến nhất của bệnh là da bị bong tróc. Vậy làm thế nào để đối phó với tình trạng này, hãy cùng tìm hiểu ở bài viết dưới đây.
-

Sĩ tử mùa thi nên ăn gì, ngủ bao nhiêu là đủ?
Các chuyên gia dinh dưỡng khuyến cáo, cùng với việc tập trung ôn luyện, các sĩ tử cần được bổ sung đầy đủ chất dinh dưỡng, có chế độ ngủ, nghỉ hợp lý, đủ giờ.
-
Động kinh ở trẻ em
Bài viết dưới đây sẽ nói về chủ đề động kinh ở trẻ em - những thông tin hữu ích mà bạn không nên bỏ qua.
-

Điểm danh các thực phẩm giúp sĩ tử có sức khỏe tốt nhất trong mùa thi
Ăn uống lành mạnh là một thói quen tốt cần duy trì mọi lúc, mọi nơi, nhưng nó có ý nghĩa đặc biệt quan trọng trong mùa thi khi mà các sĩ tử phải tập trung cao độ để có kết quả tốt nhất.
-

Vì sao người béo phì dễ bị ợ nóng hơn?
Béo phì gắn liền với những bệnh liên quan đến hệ tiêu hóa, trong đó có chứng ợ nóng. Tìm hiểu nguyên nhân cân nặng quá mức làm tăng nguy cơ trào ngược dạ dày thực quản cũng như cách để kiểm soát tại nhà.